2021年5月16-17日,全球新冠疫苗研发峰会在上海举行,各大研究院所和疫苗公司的核心研发人员对疫苗研发成果作了汇报。与会各方对各种技术路线的疫苗展开了热烈交流,并集中讨论了面对新冠突变株如何规划未来的疫苗开发。
疫苗要有很高的有效性、安全性、可及性。这是本次全球疫苗研发峰会上大家对好的疫苗达成的共识。
-
有效性体现在疫苗是否能引起高水平、持久的体液免疫和细胞免疫,以及疫苗能否对变异株起到保护作用;
-
安全性体现在不良反应微小可控,适合接种人群广;
-
可及性体现在疫苗生产、运输、保存和分发接种的成本和操作难度低。
如何研发出同时满足这些条件的疫苗、以及现有的疫苗是否能通过以上多方面的评价,是这次大会后续讨论的重点。
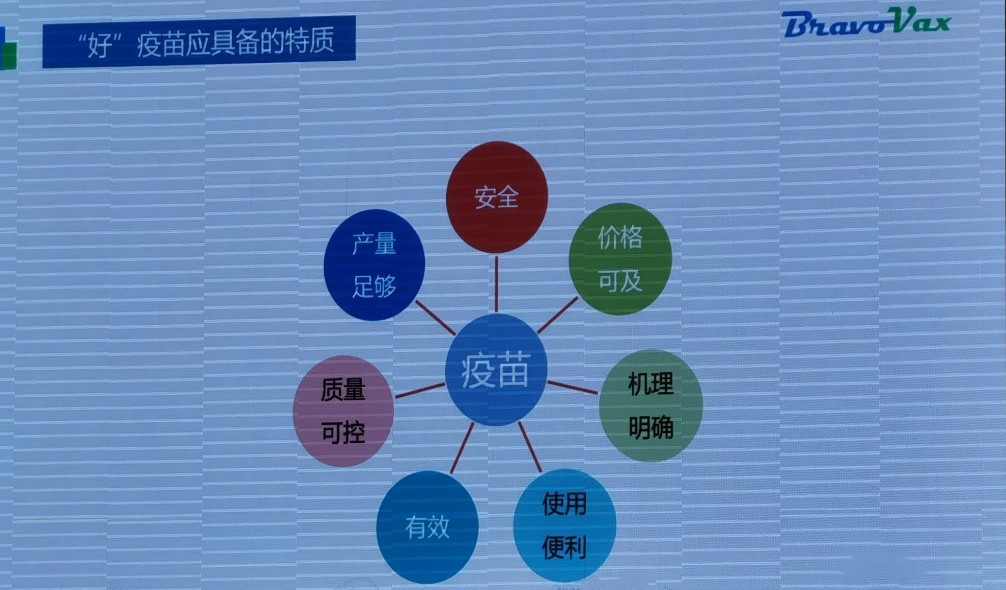
图1. 好的疫苗需要具备的特质
大会对国内外已用于大规模接种的疫苗进行了讨论和对比。评估得到的结论是,国内新冠疫苗安全性强于国外,但诱导的抗体水平相对弱于国外。目前,新冠疫苗接种率最高的国家仍然是以色列,该国国民已经基本达到群体免疫水平,而我国接种剂量虽然名列前茅,但因为人口基数大,目前全民一剂疫苗接种率在30%左右,两剂新冠疫苗的接种率大约为8.6%,距离群体免疫(>70%)仍有一定距离。
目前全球新冠疫苗开发有多种技术路线,我国采用的技术路线主要有五种,除了大家所熟知并已大范围接种的灭活病毒疫苗之外,还有腺病毒载体疫苗、重组蛋白疫苗、mRNA疫苗、纳米颗粒疫苗。其中陈薇院士团队和康希诺公司合作研发的五型腺病毒载体疫苗,以及中科院微生物所和安徽智飞生物合作研发的RBD Dimer重组蛋白亚单位疫苗已获批上市。

图2. 我国已获批的5款疫苗
(扫描文末二维码加入疫苗开发群,获取完整报告)
在此次大会上,康希诺和微生物所的研发人员对各自研发的疫苗进行了详细介绍,展示了动物攻毒实验数据和人体一期、二期临床数据,结果显示这两款疫苗均有不错的免疫效果,体现在能够诱导较高水平的中和抗体和细胞免疫,能够给接种者提供足够的保护。
五型腺病毒载体疫苗:只打一针
康希诺强调,Ad5-nCoV疫苗(克威莎)只需要单针接种,虽然存在比较常见的不良反应如发热、疼痛等,但均为一过性。研发人员还介绍,腺病毒载体疫苗是一种成熟的技术平台,此前基于腺病毒载体开发的埃博拉疫苗和登革热疫苗都已投放市场,收到良好的反馈,不存在安全性方面的顾虑。

图3. 康希诺五型腺病毒载体疫苗Ad5-nCoV(克威莎)临床数据小结
(扫描文末二维码加入疫苗开发群,获取完整报告)
RBD二聚体重组蛋白疫苗:更高效
微生物所强调重组蛋白疫苗ZF2001所用的抗原是由二硫键串联的RBD二聚体,其免疫原性好于单体形式的RBD1。之所以选用RBD片段而不是完整的Spike蛋白作为抗原,其中一个重要考虑是为了避免抗体依赖性的感染增强作用 (Antibody-Dependent Enhancement, ADE),即一些结合在非中和位点、不具有中和活性的抗体可能会加强病毒对人体细胞的感染,这种机制是此前一款菲律宾登革热疫苗失败的主要原因。而RBD Dimer疫苗通过缩小抗原片段,减少ADE效应及其它由ADE引起不良反应的可能性,降低了潜在的风险。
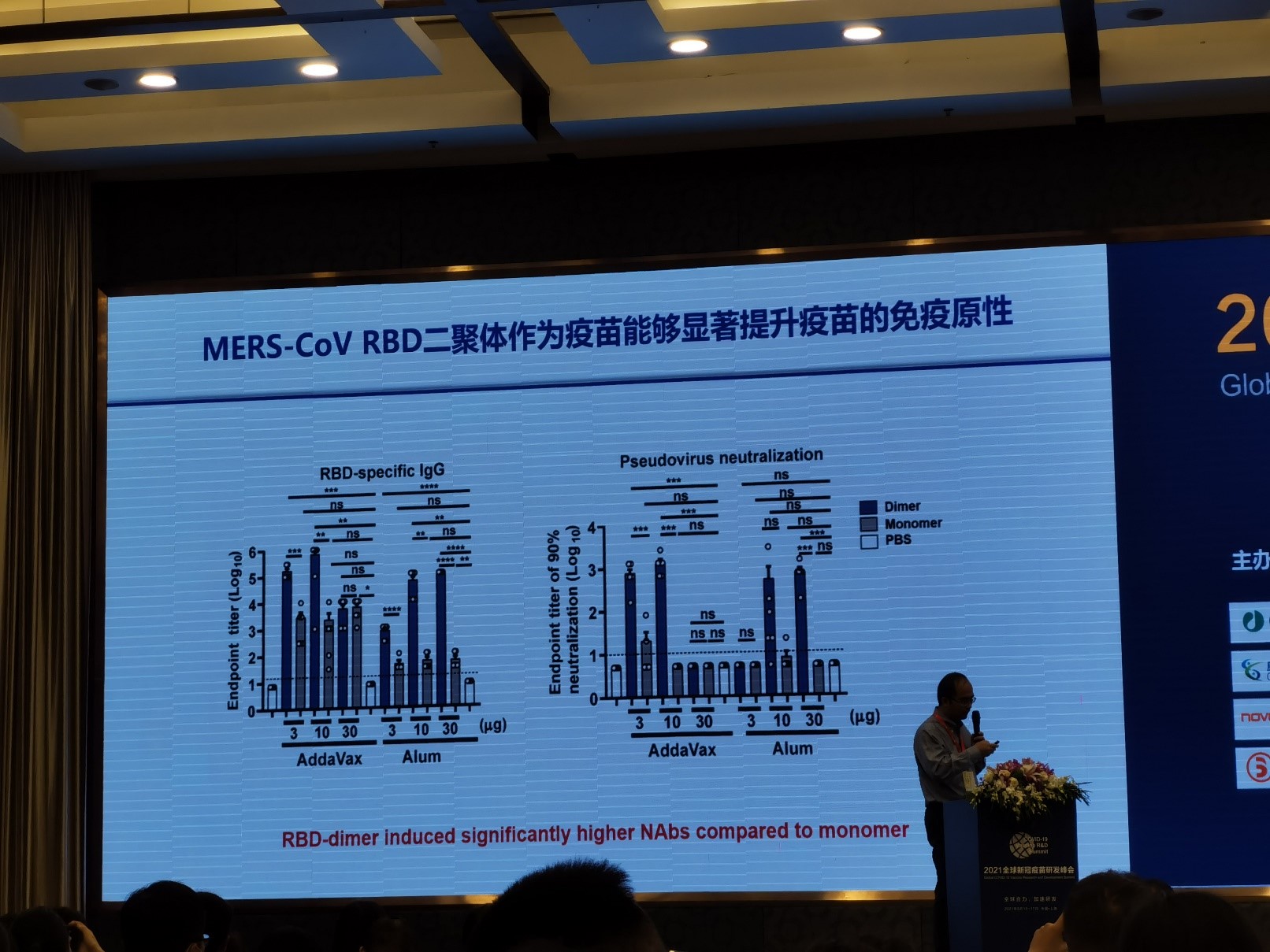
图4. 安徽智飞重组蛋白疫苗ZF2001的RBD二聚体抗原设计
(扫描文末二维码加入疫苗开发群,获取完整报告)
mRNA疫苗:创新者
除了国内已经上市或获得紧急授权使用的疫苗,许多研发者也分享了采用更为创新技术路线的在研疫苗,其中最吸引关注的是mRNA疫苗。mRNA的革命性优势在于通过在人体内中将编码抗原的mRNA翻译成蛋白质产物,这种内源性蛋白可以高效地激活Th1型细胞免疫和体液免疫两种通路,更好地引发全面的免疫应答。mRNA疫苗的制备无保护剂,无佐剂,无动物源性,无抗生素,具有相当高的安全性。目前,英、美、以色列等国家都是以Pfizer和Moderna开发的mRNA疫苗接种为主。不过,关于mRNA疫苗的主要顾虑,例如mRNA逆转录进入人体基因组的风险等,从目前的数据来看尚无明确的结论,有待更深入的评估。综合来看,mRNA疫苗除了双重免疫机制增强有效性、不含病毒成分确保安全性,还具有研发周期短、产能高的特点,对于未来各国防护新冠感染有着重大意义。
在我国处于领跑位置的mRNA疫苗是复星医药和Pfizer-BioNTech合作研发的BNT162b2 。研发者为我们详细解读了mRNA疫苗的开发工艺,并展示了从研发初期到真实世界的数据。BioNTech当时为该款疫苗立项了两个项目,BNT162b1含有基于编码RBD的mRNA,BNT162b2含有基于编码Spike全长蛋白的mRNA,经FDA评估,BNT162b2最终入选了3期临床。目前在美国,该疫苗正与大规模接种同期展开孕妇实验、第三针实验,12-16岁接种实验,6个月-11岁接种实验等。在我国港澳地区,BNT162b2已累计接种超100万剂。

图5. 复星医药和Pfizer-BioNTech合作疫苗BNT162b2在我国港澳地区使用情况
(扫描文末二维码加入疫苗开发群,获取完整报告)
对于中国何时能拥有自己的mRNA疫苗,科学家们给出了积极的反馈。目前看来,最有可能率先进入市场的是由沃森生物、苏州艾博和军事科学院军事医学研究院共同研制的ARCoV疫苗,该疫苗5月起在墨西哥开展III期临床实验。紧随其后的斯微生物疫苗和丽凡达生物的疫苗也即将进入一期临床。值得一提的是,本次参会的斯微生物代表介绍了自研mRNA疫苗的独特优势:疫苗可制成冻干制剂,克服了Pfizer和Moderna疫苗保存条件苛刻的缺点,这将极大地简便疫苗在发展中地区的运输和分发。
mRNA疫苗有着庞大而复杂的**和系统,技术壁垒较高,后来者难以轻松掌握或者绕开。近期,拜登政府计划放开mRNA疫苗**,刺激疫苗的快速大批量生产,让这种技术更适时地派上用场。初闻是全球众多疫苗开发者的福音,但实际可操作性仍待观望。

图6. 美国拜登政府宣布放弃新冠疫苗知识产权**
图7. mRNA疫苗**网2
除了mRNA疫苗,中山大学人类病毒学研究所所长张辉教授团队开发的纳米颗粒疫苗也成为了本次展会的一个焦点3。此前,纳米颗粒疫苗技术平台以及被应用于HIV疫苗、各种肿瘤疫苗和冠心病疫苗的开发。在这款独立研发的新冠疫苗中,研究者使用幽门螺旋杆菌的铁蛋白作为纳米颗粒的核心组分,在单个纳米颗粒表面同时展示24个30-40kDa的新冠RBD抗原,该设计能够提高免疫原性,有利于高效的抗原吞噬和呈递。该纳米颗粒结构在体外可以自发组装,实现共价连接。经小鼠和恒河猴模型验证,单针接种可以诱导超高的中和抗体滴度,双针接种实现抗体饱和,在抗体水平自然下降后,第三针接种迅速回抬抗体水平,证明了疫苗的高效价和诱导免疫记忆的能力。研究者将免疫后的小鼠分别进行野生型、南非株、英国株新冠病毒上呼吸道感染,结果显示小鼠的健康状况良好,证明了该疫苗在应对突变株病毒上的有效性。

图8. 中山大学病毒所张辉团队研发的新冠纳米颗粒疫苗
(扫描文末二维码加入疫苗开发群,获取完整报告)
面对层出不穷、传播越来越广泛的病毒突变株带来的挑战,尤其是已经在南亚地区肆虐的印度突变株,本次大会重点讨论了未来的疫苗解决方案。江苏省疾控中心副主任朱凤才提出了“序贯免疫”、“联合免疫”等概念,即在中和抗体水平下降后,可能需要接种第三针同种或不同的疫苗,并在此后定期接种新冠疫苗,以保证人体对新型突变具有足够的免疫力。也有专家提出,我们需要持续开发针对突变株的特异性疫苗,以保证人体能产生特异性的中和抗体。复旦大学的姜世勃教授认为,一种高效、广谱的beta冠状病毒通用疫苗将是未来所需,并以自己团队研发的RBD-Fc疫苗评价数据作为理论基础,提出疫苗的高效性决定了其持久性和广谱性。
在这次大会中,还有许多处于疫苗一线研发的科学家分享了各自的创新成果,包括清华大学张林琦教授关于疫苗理性设计(Rational design)的思路和相较于盲筛的优势分析;中科院生物物理所的王祥喜博士对新冠病毒疫苗在作用原理和机制上的深入解析,等等。其它一些疫苗开发的后起之秀,如北京天成新脉研发的重组S1-Fc疫苗、北京震旦鼎泰研发的DNA疫苗等也纷纷也登上了舞台,与大家现场分享了研发思路和实验数据。这些疫苗是否能经得起临床考验,在不远的未来值得期待。
随着病毒不断变化,新冠疫苗的研发道阻且长。总结来看,无论采用哪种技术路线,未来疫苗的大方向将集中在提高针对各种突变株的广谱性和诱导免疫效应的持久性,并在争取高效价的同时保证低风险,尽可能地把不良反应最小化。希望在科研工作者的努力下,不久的未来我国以及全世界都可以通过疫苗实现群体免疫,为一切“后新冠时代”的挑战做好准备。
为助力加速疫苗研发,ACROBiosystems基于在重组蛋白领域多年的深耕和技术积累,针对新冠疫苗研究领域开发了多种试剂盒、蛋白、抗体等核心试剂,可用于疫苗研发生产质控和疫苗有效性评价。
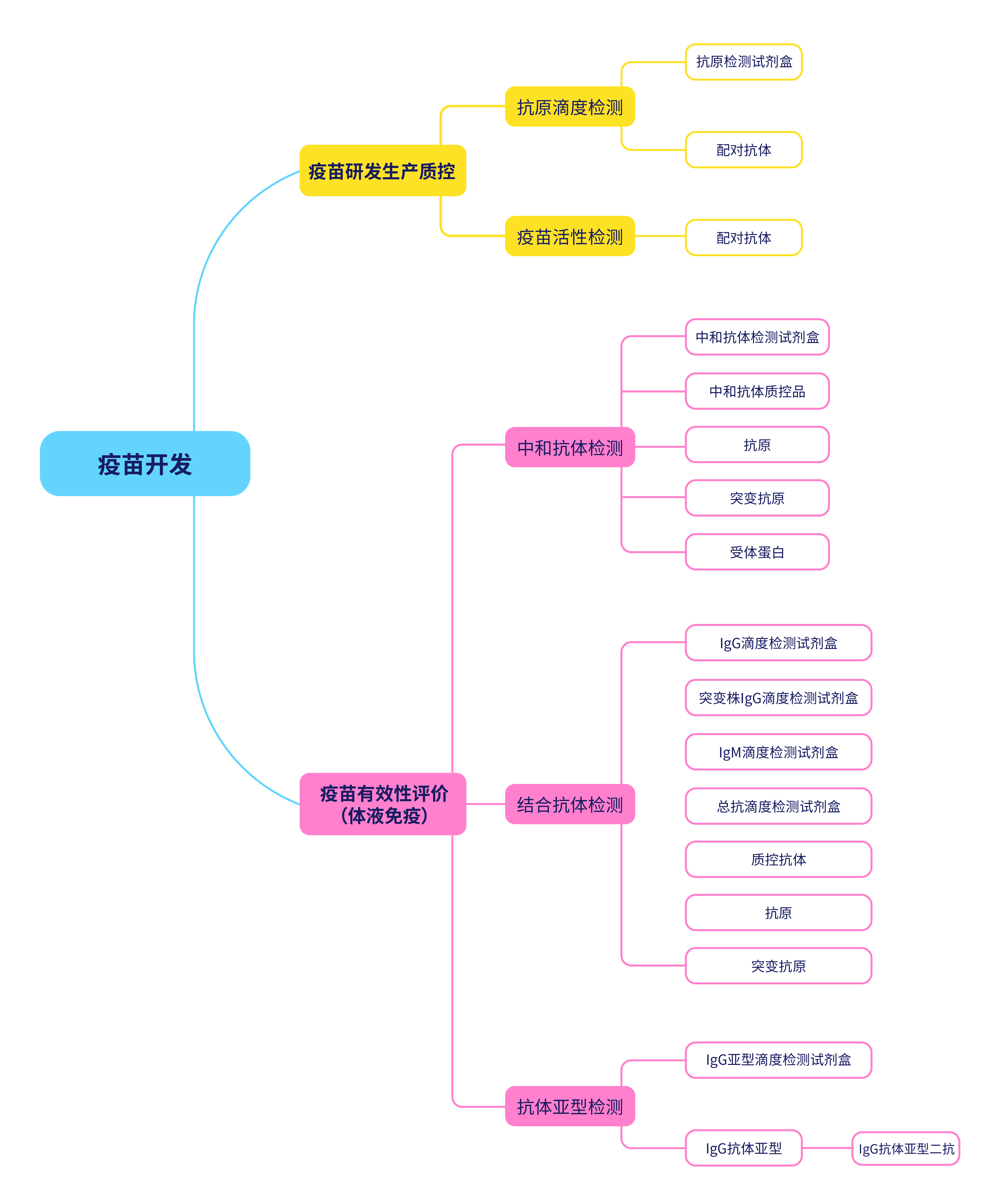
图9. ACROBiosystems可提供应用于疫苗开发各阶段的产品
| 应用领域 | 类别 | 相关产品 |
| 疫苗研发生产质控 | 抗原滴度检测 | 抗原检测试剂盒 |
| 配对抗体 | ||
| 疫苗活性检测 | 受体蛋白 | |
| 疫苗有效性评价 (体液免疫) |
中和抗体检测 | 中和抗体检测试剂盒 |
| 中和抗体质控品 | ||
| 抗原 | ||
| 突变抗原 | ||
| 受体蛋白 | ||
| 结合抗体检测 | IgG滴度检测试剂盒 | |
| 突变株IgG滴度检测试剂盒 | ||
| IgM滴度检测试剂盒 | ||
| 总抗滴度检测试剂盒 | ||
| 质控抗体 | ||
| 抗原 | ||
| 突变抗原 | ||
| 抗体亚型检测 | IgG亚型滴度检测试剂盒 | |
| IgG抗体亚型 | ||
| IgG抗体亚型二抗 |
IgG滴度检测试剂盒(RBD) (货号:RAS-A021)
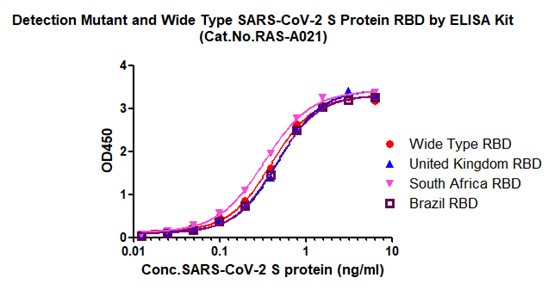
图10. 抗原检测试剂盒可检测不同突变蛋白含量
订购、询价请扫描文末二维码添加小助手咨询
中和抗体滴度检测试剂盒(货号:TAS-K022)
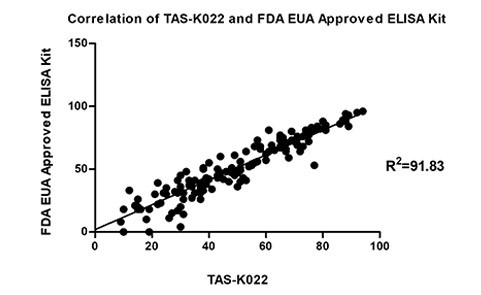
图11. 中和抗体试剂盒与FDA EUA批准同类产品相关性好(检测接种疫苗后血清中中和抗体滴度)
订购、询价请扫描文末二维码添加小助手咨询
抗体亚型检测试剂盒(货号: RAS-T014/ RAS-T015/ RAS-T016/ RAS-T017)
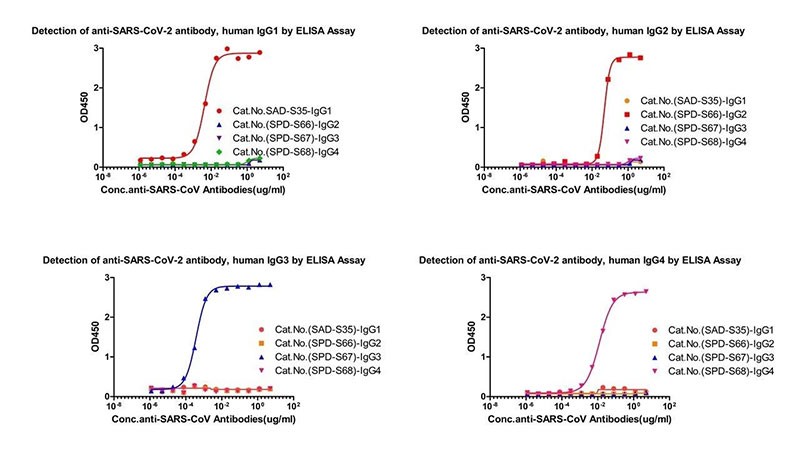
图12. 抗体亚型检测交叉验证数据图
订购、询价请扫描文末二维码添加小助手咨询
广谱型中和抗体(货号:S1N-M122)
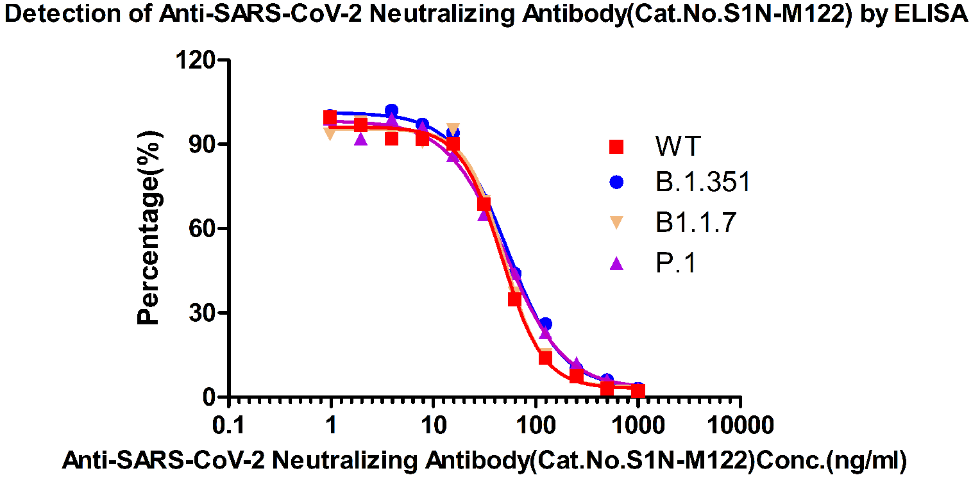
图13. ELISA方法检测中和抗体S1N-M122对突变株的中和能力
订购、询价请扫描文末二维码添加小助手咨询
我们建立了一个开放、专业、有深度的疫苗开发资源共享和技术交流平台,本群聚焦疫苗领域研发进展情况、工艺和质量控制、临床研究进展等相关主题的讨论、热点文章分享和解读。也希望大家能够更多的参与进来,讨论各类问题~
近期我们会在群里分享上海新冠疫苗会议部分演讲PPT供大家学习哦~ 请持续关注群内消息。

(请备注:公司+姓名+疫苗)
还有更多学习资源分享,马上扫码入群吧~
相关阅读:
都是mRNA疫苗,辉瑞和莫德纳的新冠疫苗有什么不一样(内附FDA专家组答辩PPT)
一针见效!康希诺和强生腺病毒载体疫苗获批(内附强生FDA专家组答辩PPT)
如果你对相关疫苗FDA专家组答辩PPT感兴趣,也欢迎添加小助手微信联系获取哦~
参考文献:
您可通过以下方式联系到ACROBiosystems:
邮件:inquiry@acrobiosystems.com
电话:15117918562

(备注:姓名+公司)

